

科研动态 |从生态学角度审视皮肤微生态变异的驱动因素
发布日期:2022-11-09 14:43:09 作者: 来源:
浏览次数:26959
复旦大学--粤港澳大湾区精准医学研究院(广州)王久存-夏晶晶课题组近期在Phenomics发表皮肤微生态相关重磅综述Skin microbiome, metabolome and skin phenome, from the perspectives of skin as an ecosystem(从生态学角度审视皮肤微生态变异的驱动因素)。该文结合近300篇参考文献,首次从经典生态学角度重新审视皮肤这一生态系统,围绕皮肤微生物组、代谢组以及皮肤表型组展开讨论,试图解析复杂生态系统变异背后的根本驱动因素,由繁入简探索微生物群落形成背后的根本规律。
该文综述:
(1)皮肤生态环境中来自宿主和环境的物质/营养物质的组成及其对皮肤微生物组的作用;
(2)皮肤优势菌群通过自适应和微生物-微生物相互作用占据生态位的特征;
(3)皮肤微生物如何通过其自身结构或生物活性分子重塑宿主皮肤表型,包括皮肤免疫、维持皮肤生理机能(如pH值和水合作用)、紫外线(UV)防护、气味产生和伤口愈合。该文旨在从生态学的角度重新审视宿主与微生物的相互作用,以期为这一领域的研究及皮肤健康相关产品的研发提供新的启示。
论文DOI链接:https://link.springer.com/article/10.1007/s43657-022-00073-y
论文PDF链接:https://link.springer.com/content/pdf/10.1007/s43657-022-00073-y.pdf
皮肤是一个复杂的生态系统,寄居着数以百万计的微生物,包括细菌、真菌和病毒。皮肤微生物群在维持宿主皮肤健康方面发挥着重要作用。
分析皮肤微生物群落结构是概述生态系统和解决宿主-微生物相互作用的第一步。然而,这个系统被证明是高度个性化和极其复杂的。该系统的组成受到众多因素的影响,如种族、性别、年龄、生活方式(如职业、卫生、皮肤产品和药物使用和饮食)和环境(如气候、地理位置、污染、紫外线和其他辐射)。然而,从经典生态学的角度来看,这些因素大多只是间接影响,而不是驱动系统的建立和维持的直接因素。构成生态系统驱动力的主要选择压力包括资源可用性(营养物质)、环境条件(温度、地理可及性)和生物因素(天敌和病原)。在这篇综述中,作者们围绕这些基本选择压力的相关研究进行总结,包括皮肤存在的不同种类的营养物质、皮肤微生物通过自我适应选择偏好的微环境及通过微生物-微生物相互作用抢占生态位、以及皮肤微生物如何通过其结构或生物活性分子重塑宿主皮肤表型(图1)。
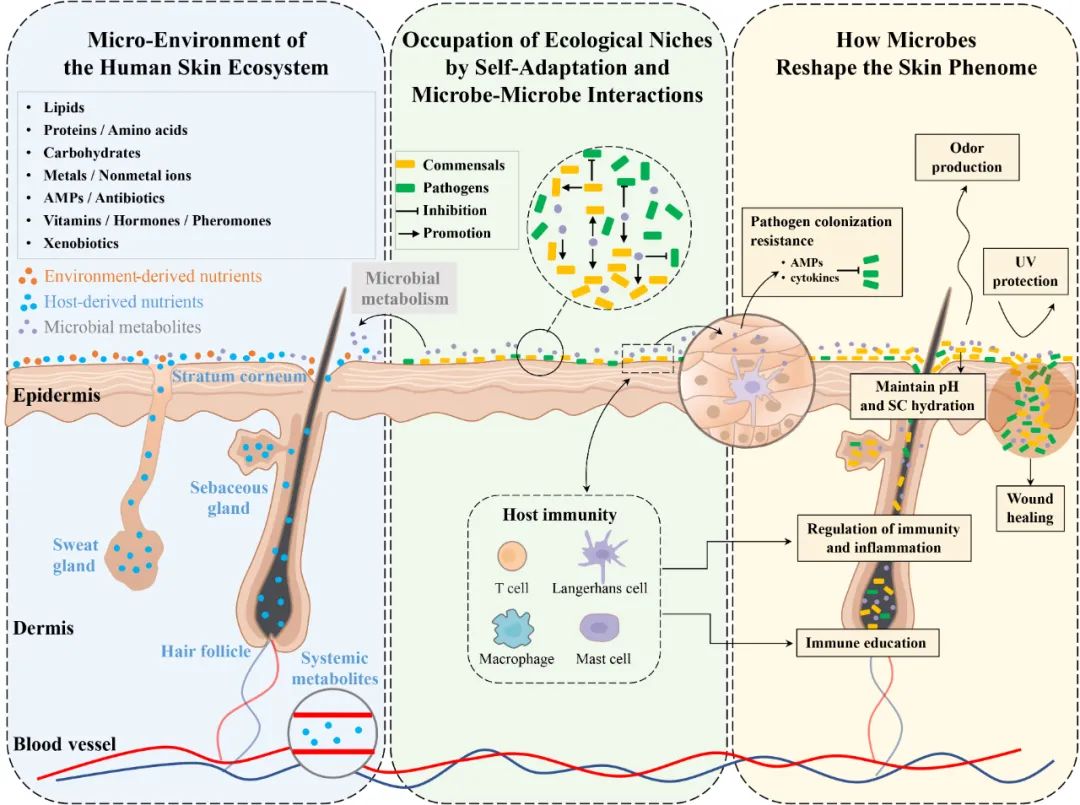
图1 从皮肤生态系统的角度看,分为皮肤微生物组、代谢组和皮肤表型组。从左至右(蓝框):由宿主(角质层、皮肤附属物和血浆)、环境(外来生物)和微生物代谢产生的各种物质覆盖皮肤表面,形成皮肤微生物群的微环境;(绿框)皮肤微生物通过自适应和微生物-微生物相互作用占据生态位,促进共生或抑制病原体;(黄框)皮肤微生物,通过自身的结构或生物活性分子,重塑宿主皮肤表型。
皮肤生态环境中来自宿主和环境的物质/营养物质的组成及其对皮肤微生物群的作用
宿主皮肤为微生物的生存、竞争和合作提供营养和庇护所。营养物质一方面可以通过滋养或迫害直接影响微生物的定植、生长和代谢;另一方面,这些物质也可能对局部微环境(如pH或水分状态)进行微调,从而对微生物的生存产生间接影响。微生物能量物质主要来自宿主皮肤和外界环境。宿主皮肤来源的营养物质包括嵌在“砖和灰浆”结构中的脂质、角质层(SC)中成堆的死无核角质细胞以及皮肤附属物(毛囊(HFs)和腺体)的分泌物。环境来源的营养素包括个人护肤品、药物和其他环境异源物质。在该文中,作者们总结了人体皮肤表面目前已被检测出的物质(可作为微生物潜在能量物质)及这些物质对皮肤相关的影响,117篇文献涵盖8大类物质,包括金属/非金属离子(25),氨基酸及其衍生物(32),蛋白质、肽及其衍生物(72),糖类(7),脂质(100+),维生素(5),信息素(5),异源物质(28)(详细内容可参见原文表1)。
众所周知,即使是同一个体,在不同的生命阶段,其皮肤和附属器的精细结构或分泌功能也存在显著差异,它们持续产生代谢物,从而在塑造具有不同的pH值、盐分、水分、皮脂含量和含氧量的微环境中发挥重要作用。影响全身代谢的因素,如饮食、肠道菌群和激素水平,也可以显著影响皮肤的局部微环境。此外,暴露组(如环境污染,紫外线水平,职业环境,药物或护肤习惯)是高度个性化的。这些因素共同创造了皮肤表面高度复杂的物理和化学景观,可能是皮肤微生物群个体差异的真正生物学原因。
皮肤优势菌群通过自适应和微生物-微生物相互作用占据生态位的特征
皮肤表面形成不同的微生境,许多研究倾向于根据解剖部位的物理特性将其分为四种类型(皮脂腺、湿润、干燥和足部)。虽然这种水基/油基分类不够精细,但微生物群生长和定植的一些突出特征得到了很好的识别。其他代谢产物和物理性质也被确定能够调节微生物群落。此外,微生物与微生物的相互作用对塑造皮肤生态系统至关重要。一般来说,微生物会通过以下方式来适应生存环境和竞争生态位:1)对特定环境条件的自我适应:皮肤微生物会改变自身代谢途径等特征来适应皮肤微环境。例如,葡萄球菌合成的表面活性剂以耐低pH和高盐含量的汗水;2)通过微生物-微生物相互作用竞争生态位,例如凝固酶阴性葡萄球菌(CoNS)通过分泌不同调控因子,可以直接杀死或限制金黄色葡萄球菌的毒力。原文归纳了皮肤微生物抢占特定生态位的特征,包括不同微生物偏好的微环境、自我适应的生物学基础以及微生物“战争”,58篇文献涵盖30种常见皮肤微生物类型(详细内容可参见原文表2)。
与皮肤表面相比,HFs提供更多的水分和酸性环境,并提供紫外线保护,促进多种细菌、真菌和病毒的定植。HFs中细菌最丰富的是痤疮丙酸杆菌。限制分枝杆菌和球形分枝杆菌是优势真菌。同时,HF病毒群包括依赖病毒、丙酸杆菌噬菌体P100D和101A、乳头瘤病毒和腺相关病毒。此外,蠕形螨通常位于漏斗远端,通常它们的背身朝向毛干。
皮肤微生物如何通过其结构或生物活性分子重塑宿主皮肤表型
皮肤微生物群利用宿主皮肤和环境中的“营养物质”,产生一系列具有重要功能的生物活性分子。例如,皮肤微生物群可以通过蛋白酶将宿主蛋白质转化为氨基酸,将碳水化合物发酵为乳酸或将皮脂成分如甘油三酯分解为游离脂肪酸。此外,皮肤微生物群会产生AMPs、PSM和抗生素。这些代谢产物可能进一步作用于宿主或其他微生物,发挥生物作用,重塑皮肤表型。
研究最深入的皮肤共生菌功能包括:
(1)通过阻断生态位抵抗病原菌定植,以抵御机会性或致病性微生物的入侵;
(2)早期免疫教育;
(3)调节免疫和炎症。
鉴于已经有很多关于这些功能的全面综述,该文作者特别关注其他皮肤内稳态中重要的功能,包括皮肤生理机能的维持(如pH值和SC水合作用)、紫外线防护、气味产生和伤口愈合。
01 调节免疫和炎症
微生物群是短链脂肪酸的重要来源。例如,痤疮丙酸杆菌发酵碳水化合物为丙酸;表皮葡萄球菌能够在体外发酵甘油生成丁酸和乙酸。SCFAs可以调节多种免疫细胞功能,包括细胞因子(TNF-α,IL-2,IL-6和IL-10)的产生,激活常驻皮肤调节T(Treg)细胞,减轻炎症皮肤反应,从而有助于维持小鼠和人的皮肤免疫稳态。丁酸能显著减弱脂多糖(LPS)诱导的核因子-κB (NF-κB)的激活和小鼠巨噬细胞一氧化氮的产生,减少干扰素γ (IFNγ)诱导的巨噬细胞IL-6和TNF-α的产生,以及介导的短链脂肪酸受体2 (FFAR2)调节小鼠紫外线B (UVB)诱导的促炎细胞因子的产生。此外,SCFAs能够调节免疫细胞向感染病灶迁移的能力。鉴于短链脂肪酸的潜在抗炎作用,有研究在体外将丁酸应用用于银屑病皮损。此研究发现,局部应用丁酸钠可恢复银屑病皮肤G蛋白偶联受体(GPR)—— GPR43和GPR109a表达下降,并抑制炎症因子表达。然而,短链脂肪酸并不总是抗炎的。痤疮丙酸杆菌来源的短链脂肪酸抑制皮肤角质细胞中组蛋白去乙酰化酶(HDAC)的活性,并通过toll样受体(TLR)信号通路刺激炎症反应。来自痤疮丙酸杆菌的短链脂肪酸在人类皮脂细胞中具有强大的促炎作用。在高脂肪饮食条件下,棒状杆菌的一种主要成分——分枝酸的表达使细胞壁变厚,并以IL-23依赖的方式促进小鼠的炎症反应。
02 病原菌定植抗性
皮肤共生菌群通过微生物-微生物相互作用争夺生态位。在角质细胞中直接诱导AMPs或细胞因子表达是皮肤共生菌群(如丙酸杆菌和表皮葡萄球菌)防御病原体入侵和塑造皮肤微生物群的主要策略之一。此外,共生菌群作为皮肤免疫系统的内源性辅助因子,促进皮肤局部免疫应答。皮肤中有大量的共生菌群特异性T细胞,例如表皮葡萄球菌可以激活表皮葡萄球菌特异性IL-17A+ CD8+ T细胞,并间接诱导角质形成细胞(KC)产生AMP,从而保护皮肤免受外源性病原体的感染。表皮葡萄球菌也可诱导KC表达IL-1α,从而促进小鼠皮肤αβ T细胞产生IL-17A和IFNγ。IL-17A诱导趋化因子招募中性粒细胞和AMP的产生,从而保护宿主免受病原体感染。在成人中,皮肤黏膜相关不变性T细胞(MAIT细胞)是产生IL-17A的淋巴细胞的主要群体。无菌(GF)小鼠中不存在MAIT细胞,其发育受维生素B2等微生物代谢物控制。MAIT细胞可以以IL-1-、IL-18-和抗原依赖的方式对皮肤共生菌群或共生菌群衍生的代谢物做出反应,从而增强对病原体入侵的抑制。
03 免疫训练
共生体在调节先天免疫免疫细胞的发育、增殖、成熟和活化中起着重要作用。之前的研究发现,GF小鼠含有大量未分化的肥大细胞(MCs),并且干细胞因子(SCF)表达异常低。共生菌诱导KC产生SCF,促进皮肤细胞成熟。皮肤中MCs的迁移完全依赖于KC产生的高水平SCF 。此外,在识别微生物代谢产物之一——脂质中发挥重要作用的γδT细胞,其分泌IL-17的能力在GF小鼠中显著下降。不同于对侵入性病原体的免疫反应,共生菌群可以在非炎症条件诱导皮肤的适应性免疫反应,这有助于建立免疫稳态。
04 维持pH和SC水合度
皮肤微生物群代谢死亡的角质细胞、汗液和皮脂成分以及其他废物,并将它们转化为氨基酸,如谷氨酸和天冬氨酸、蛋白质和各种FFAs。微生物自身还可以分泌乳酸、一系列短链脂肪酸和其他有机酸。这些酸性代谢物可以调节皮肤表面pH值和SC水合度。皮肤表面pH值为微酸性,人的pH值范围在4.5-5.5之间。SC的pH值对许多重要的表皮功能至关重要,包括渗透性屏障稳态、角质细胞脱屑、炎症启动、分泌板层体(LB)极性脂质的处理和抗菌防御。此外,pH的变化也会影响SC的厚度和色素沉着。这些结果表明,许多皮肤特征可能相互影响,如pH值、表皮水分流失(TEWL)、皮肤厚度、SC水化和色素沉着,并可能受到皮肤微生物及其代谢产物的调节。
05 UV防护
一些皮肤共生菌可以通过分泌不同的代谢物来保护皮肤免受紫外线伤害。例如,表皮葡萄球菌可以产生6-HAP抑制紫外线诱导的小鼠肿瘤。皮肤菌群从L-组氨酸产生顺式尿苷酸,影响紫外线诱导的免疫抑制和抑制黑色素瘤生长。一些链霉菌衍生的化合物(如酰胺)具有吸收紫外线、抗氧化和抗炎的特性。痤疮丙酸杆菌发酵产生的丙酸可以改善UVB诱导的黑色素合成。众所周知,紫外线辐射(UV-R)可以抑制Malassezia furfur的细胞生长。另一方面,Malassezia furfur可以产生糠秕马拉色菌素,一种可以过滤紫外线的化合物,被认为具有保护作用。据推测,这种真菌开发紫外线过滤化合物是为了减少紫外线伤害,并与其他共生菌竞争生存。然而,他们没有发现糠皮菌素对共生菌如金黄色葡萄球菌、表皮葡萄球菌或白色念珠菌有任何不良影响。
06 气味产生
一些皮肤微生物的代谢活动会产生特殊的气味。人体的体味被认为是由细菌对腋窝区域的腺体的分泌物分解产生的。微生物存在于哺乳动物的特定气味腺或组织中,并调节特定的气味。皮肤微生物代谢宿主汗液并产生挥发性代谢物,增强了人类汗液对疟疾蚊子的吸引力。皮肤共生的莫拉氏菌是一种对干燥和紫外线照射具有高度耐受性的物种,存在于各种生活环境中,尤其是在洗衣房。这种物种有可能产生4-甲基-3-己烯酸(4M3H),这种酸通常被描述为“湿和脏的抹布一样的臭味”或“酸性或汗臭味”。除细菌外,真菌也是许多挥发性有机化合物的重要来源,包括醇、醛、酯、FAs和萜烯。在恶性真菌感染伤口(MFWs)中,代谢物如二甲基三硫化物(DMTS)、四种脂肪酸挥发物(乙酸、异丁酸、丁酸和异戊酸)和腐胺与恶性真菌感染伤口气味的成分有关。
07 伤口愈合
伤口愈合是一个复杂但高度调控的过程,对皮肤屏障功能至关重要。皮肤伤口中微生物的存在和丰度取决于伤口类型(慢性/急性伤口) ,并随时间变化。研究表明,皮肤微生物群也以多种方式参与伤口愈合。表皮葡萄球菌通过上调TLR和下调皮肤CD8+ T细胞中的TNF-α,促进角质形成细胞快速进展。来自微生物群的代谢产物也可以促进伤口愈合,例如,来自表皮葡萄球菌的脂磷壁酸可以通过TLR2信号降低炎症反应。另一方面,一些潜在的病原体不利于皮肤伤口愈合。如金黄色葡萄球菌、Acinetobacter. baumanni 和 A. junii 在SC上形成生物膜,并对人真皮成纤维细胞迁移产生不利影响,最终导致细胞凋亡。微生物稳定性被认为对皮肤健康至关重要;然而,慢性伤口的时间稳定性与较差的愈合有关,可能是因为微生物组的不稳定性促进了免疫系统更加有效地清除伤口细菌。
总结
该文从皮肤作为一个生态系统的角度,围绕目前对皮肤微生物组的认识,试图探索高度个性化的微生物特征的建立和平衡的根本驱动力。该文作者认为,微环境定义了物理条件(如pH值、氧)和化学条件(碳源和代谢物),从而驱动微生物组的组成。反之,这些微生物可能通过微生物-微生物或微生物-宿主的相互作用重塑这个环境。皮肤表面代谢组可能是解决皮肤微生物组和皮肤表型之间的因果关系的关键方法;因此,未来的皮肤微生物组研究应该利用这些多组学来揭示这些强相关性,并用科赫假设的原则来验证它们。此外,考虑到宿主基因组和暴露的复杂性,纵向时间序列研究应更多地考虑这些变量的控制和这些网络的方向。基于坚实的因果关系,我们可以针对特定的皮肤微生物开发准确的干预措施,并最终重塑皮肤状况。
Abstract
Skin is a complex ecosystem colonized by millions of microorganisms, including bacteria, fungi, and viruses. Skin microbiota is believed to exert critical functions in maintaining host skin health. Profiling the structure of skin microbial community is the first step to overview the ecosystem. However, the community composition is highly individualized and extremely complex. To explore the fundamental factors driving the complexity of the ecosystem, namely the selection pressures, we review the present studies on skin microbiome from the perspectives of ecology. This review summarizes the following: (1) the composition of substances/nutrients in the cutaneous ecological environment that are derived from the host and the environment, highlighting their proposed function on skin microbiota; (2) the features of dominant skin commensals to occupy ecological niches, through self-adaptation and microbe–microbe interactions; (3) how skin microbes, by their structures or bioactive molecules, reshape host skin phenotypes, including skin immunity, maintenance of skin physiology such as pH and hydration, ultraviolet (UV) protection, odor production, and wound healing. This review aims to re-examine the host–microbe interactions from the ecological perspectives and hopefully to give new inspiration to this field.
第一作者
陈慧真,复旦大学人类表型组研究院一年级博士生。2020年本科毕业于华东理工大学,以专业第一的成绩推免至复旦大学;硕博连读。研究方向为皮肤微生物组,特别关注衰老人群的皮肤微生物组特征及其与表型的关系。
通讯作者
王久存教授,复旦大学生命科学学院和人类表型组研究院教授、博导,复旦大学人类遗传学与人类学系主任,复旦大学风湿免疫过敏性疾病研究中心副主任,皮肤表型组学研究联合实验室共同主任;中国医学科学院皮肤及皮肤病群体遗传学和防控新技术研究创新单元共同主任;上海人类学学会会长,上海市遗传学会秘书长;硬皮病临床与研究国际协作网(InSCAR)共同发起人和副理事长。研究方向主要包括硬皮病、强直性脊柱炎等风湿免疫病的遗传学、表观遗传学和分子机制研究,以及皮肤表型组学研究。曾承担国家国际科技合作专项、美国NIH U01等国际合作项目;正在承担国家自然科学基金重点项目、中国医学科学院创新基金、上海市市级科技重大专项示范课题等项目。发表SCI论文200余篇。
夏晶晶博士,粤港澳大湾区精准医学研究院(广州)青年研究员。毕业于同济医学院临床医学专业;德国马普所心肺所药学/法兰克福大学医学院医学博士(最优等学位);曾任德国科隆大学衰老相关疾病细胞应激反应研发中心(CECAD)博士后;德国IUF莱布尼茨环境医学研究所/复旦大学遗传与发育协同创新中心联合博士后; 复旦大学人类表型组研究院助理研究员。师从国际知名皮肤病学专家Jean Krutmann(德国)院士及复旦大学人类遗传学与人类学系系主任王久存教授。主要研究包括:1)利用多组学(宏基因组、皮肤表型组、代谢组)研究皮肤微生物组与皮肤健康的关系,目标是开发基于微生物的标志物和新疗法(益生元、益生菌和活体生物治疗产品),重塑宿主皮肤稳态。2)研究环境暴露组与皮肤老化的关系,并解析“环境传感器”芳基烃受体(AHR)在皮肤中的作用。科研成果详见:https://www.ipm-gba.org.cn/Index/team_details/id/251.html。
粤港澳大湾区精准医学研究院
GREATER BAY AREA INSTITUTE OF PRECISION MEDICINE
 公众号二维码
公众号二维码
版权所有© 粤港澳大湾区精准医学研究院 粤ICP备2021038868号 粤公网安备 44011502000710号
